生命如同一部波澜壮阔的舞台剧,遗传基因是剧本,将剧本进行生动演绎的表演设计师则是表观遗传。在真核生物的细胞核内,染色质的化学修饰,及其凝聚与松弛状态的形成、维持与切换,影响着遗传信息的表达。这种机制被称为表观遗传调控,是生物表型复杂性和多样性的关键保证。组蛋白去乙酰化酶Rpd3是一类全局基因调控和共抑制因子,人源Rpd3S复合物的功能异常与肿瘤、心血管疾病发生相关,是健康维护及药物开发的重要靶点。
基础医学院李海涛教授团队和生命学院闫创业副教授团队合作在Rpd3S介导的染色质去乙酰化动态调控机制上取得重要突破,相关成果以“组蛋白H3第36位赖氨酸三甲基化(H3K36me3)指引下的多模式Rpd3S核小体去乙酰化”为题在《自然》(Nature)期刊作为研究长文发表,系统全面地对Rpd3S的结构、底物识别催化,以及修饰调控等过程进行了分子机制解析,揭示出甲基化指引的染色质去乙酰化动态和多模态模型,为疾病预防、药物研发、再生医学等领域带来了新曙光。李海涛和闫创业为文章的共同通讯作者,基础医学院博士后管海鹏和2017级博士生王沛为并列第一作者,2020级博士生张沛参与了主要研究。本成果入选2023年清华大学最受师生关注的年度亮点成果。
为使生命这部编排精密的舞台剧顺利演绎,不同功能的组蛋白在相关酶的作用下发生甲基化、乙酰化等多种翻译后修饰,如同性格各异的演员穿着各色衣帽、使用各式道具上演环环相扣的多彩剧情。
1996年,Rpd3首次被报道作为组蛋白去乙酰化酶(HDAC)发挥作用,这一发现与同年组蛋白乙酰转移酶(HAT)GCN5的转录共激活功能发现一起,标志着现代表观遗传学的兴起。但在其后的20年间,Rpd3的分子结构及其调控机制一直没能得到深度解析,成为表观遗传领域的关键谜题之一。
随着冷冻电镜技术的发展和化学生物学的兴起,科研人员对揭开这一表观遗传调控机制之谜的愿望愈发强烈。2017年,李海涛带领课题组开始布局此项研究。

研究人员合影(从左至右:王沛、李海涛、闫创业、管海鹏、张沛)
从最初的实验样本获取开始,难题与挑战就纷至沓来。在酵母中,Rpd3与多种亚基Sin3、Ume1、Rco1、Eaf3组装形成Rpd3S复合物。相比其他复合物,去乙酰化酶的催化模式更有动态性。“对我们来说,蛋白质的柔性太大。”李海涛说,如同运转中的风扇,无法辨认出有多少只叶片在转动,必须将风扇暂停,才能看清其叶片构造。而让蛋白质“暂停”的方法,则有赖于生化纯化与冷冻制样技术。
想要通过电镜捕捉到稳定的蛋白质结构,首先要在冷冻制样过程中将蛋白质均匀分散。去垢剂是应用较为广泛的优化蛋白质可溶性表达的条件,“我们试了很多种去垢剂,又试了聚乙二醇等,都失败了。” 管海鹏回忆道,“后来在李老师的指导下,尝试用甘油这类具有双极性的小分子。”甘油的浓度高于5%时,会影响成像衬度,使电镜图像的明暗差异降低,不利于识别。于是,团队在0%-5%的甘油浓度范围内展开梯度筛选实验,发现浓度在2.5%以上适宜优化样品。
从尝试去垢剂到甘油浓度实验,经过近一年的筛选,团队最终确定甘油浓度为3%时,酿酒酵母Rpd3S复合物在冷冻制样过程中呈现稳定的均匀分散状态,“这是我们课题组能解析出Rpd3S复合物分子结构的重要原因。”管海鹏说。

实验操作
研究者用化学生物学手段合成出性质均一的修饰组蛋白,并成功组装出多种修饰组合类型的“人工设计”核小体,随后开展了Rpd3S与修饰核小体复合物的结构解析攻关。然而柔性的干扰仍然存在,对此,闫创业团队在处理柔性结构的数据方面经验丰富。于是,两个团队通力合作,放弃了过年的休息时间联手攻关。
终于,2020年正月初九,正在实验室里的管海鹏和王沛拿到突破性数据,意味着Rpd3S在被发现20多年后即将向人们展露其分子结构!彼时,整个研究团队在实验室和微信群中欣喜若狂,共同庆祝突破性数据的到来。
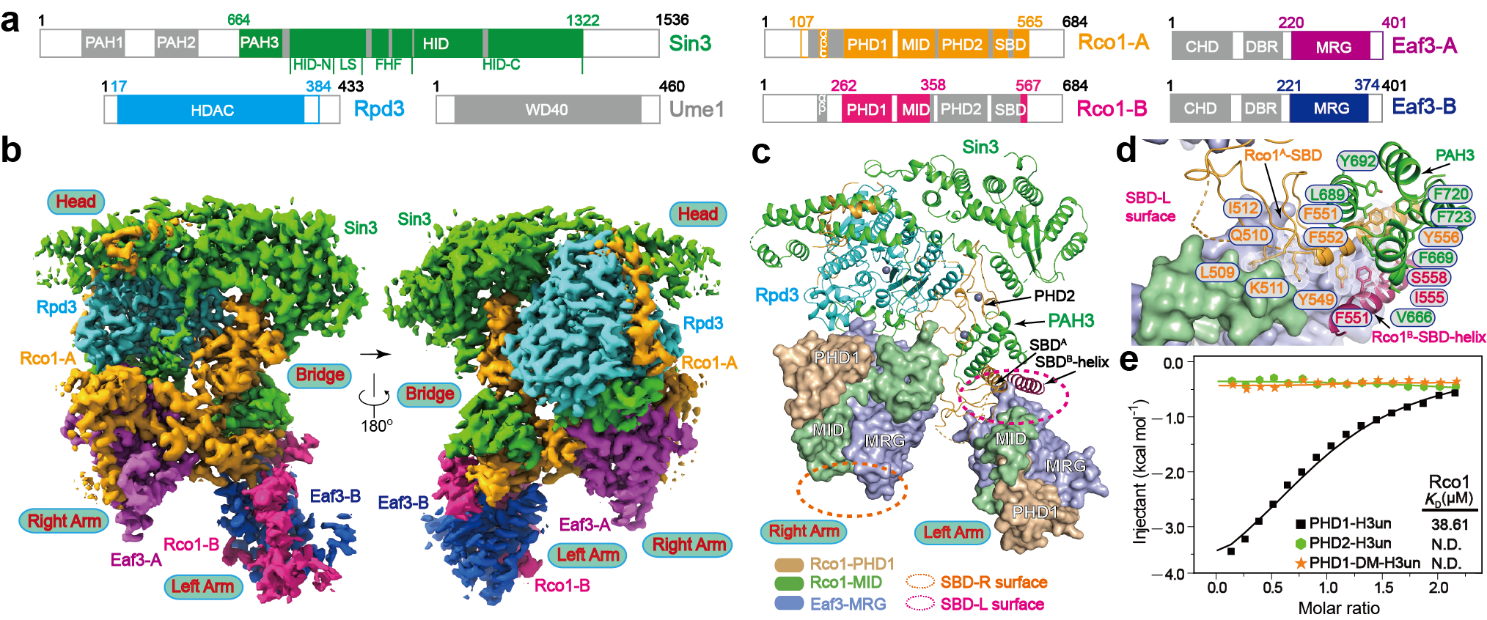
Rpd3S复合物整体结构以及亚基间相互作用与调控

Rpd3S复合物与核小体的结合
综合单颗粒冷冻电镜与化学生物学等跨学科技术,李海涛课题组解析出了酿酒酵母Rpd3S复合物在自由状态和结合H3K36me3核小体状态下的分子结构模型。“这足以发一篇重磅论文,但我们不满足止步于此。”李海涛说,“我们要进一步探究其修饰的调控机制,将捕捉到的Rpd3S结构‘快照’置于生理的生命动态调控过程中,才是有意义的。”随后攻关团队布局开展了生化酶活和酵母遗传学等功能实验。
去乙酰化可以维持基因的正常转录延伸并防止异常转录发生。Rpd3S会对甲基化核小体中的组蛋白H3、H4进行识别,然后去除组蛋白上乙酰化位点。在系统化探究这一调控模式时,研究者发现H3有5个乙酰化位点,H4有4个乙酰化位点,而甲基化的位点更多,需要通过大量生化实验不断验证每个位点酶活水平的变化。
“我们分段合成了不同的多肽底物,再利用化学链接的方式构建出带有不同修饰状态的组蛋白。”王沛介绍道。合成多肽应用了化学系教授刘磊的蛋白质精准合成技术,其制备的样本十分昂贵,合成操作需要研究者胆大心细。“虽然样本昂贵且量小,但操作时我们并不会紧张,因为李老师一直让我们放手去做,给我们创造了轻松的科研环境。”王沛笑着说,“他对我们的每一步小进展都给予鼓励,是我们的‘夸夸群群主’。”
在结构探究过程中,课题组意外发现Rpd3S具有独特的非对称架构。在Rpd3S中,Eaf3、Rco1、Rpd3、Sin3结合形成催化核心复合物,而其中的两组Eaf3-Rco1异源二聚体呈现出不对称组装方式,如同各司其职的左手与右手,会运用不同“道具”进行协同催化调控。

Rpd3S复合物在以修饰核小体为底物时的去乙酰化酶活
左手一侧,Eaf3、Sin3、Rco1的组合通过对两个H3K36me3标记、核小体DNA和连接DNA的多价识别,将Rpd3的催化中心定位在H4 N末端尾部附近,进行去乙酰化。
另一种调控模式位于右手一侧。Eaf3和Rco1对未甲基化的H3第四位赖氨酸(H3K4un)和H3K36me3进行组合读取,引导H3去乙酰化。但在该过程中,H3乙酰化的第9位赖氨酸(H3K9ac)修饰被特异性保留,课题组继而对这一特殊情况展开系统研究。研究者通过突变实验影响H3K9ac乙酰化的建立,发现缺失H3K9ac修饰几乎影响着H3和H4所有其他位点乙酰化水平的建立。课题组据此提出,H3K9ac修饰和H3K36me3修饰可以作为“种子”,被乙酰化转移酶NuA3、NuA4识别和快速H3、H4乙酰化修饰重新建立。
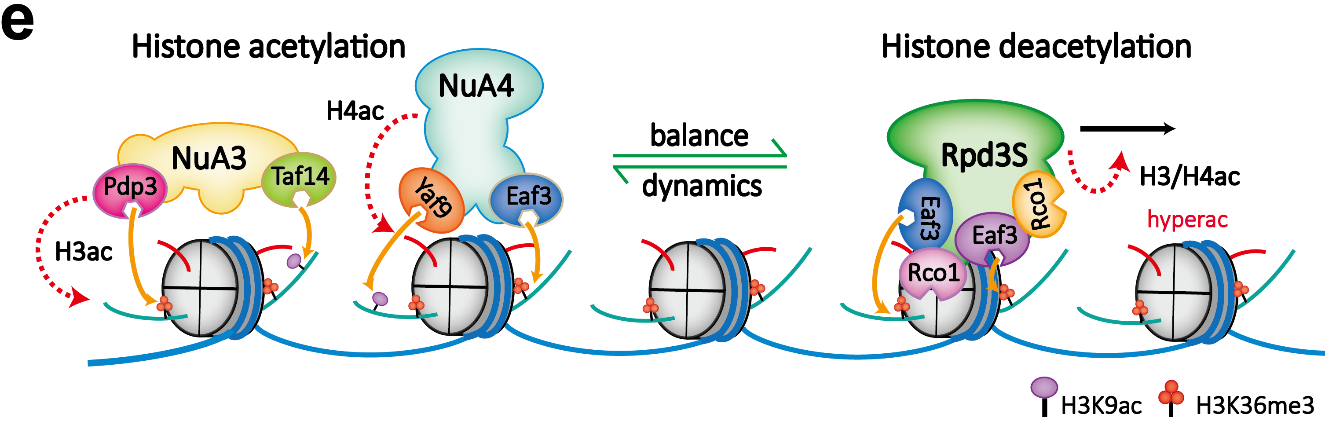
Rpd3S-NuA3/NuA4在转录过程中动态调控染色质乙酰化水平模型
在对Rpd3S“左右手”的探究中,由于复合物具有动态性,研究者只能看到其左手一侧,对于右手一侧的解析则使用了系统的遗传学及生物化学手段,从而全景式呈现了Rpd3S的结构与催化机制。
然而体外的酶活实验并不能代表复合物在体内的调控模式,课题组又进一步探究了野生型Rpd3S和突变株在酵母表型上的影响,其结果与体外的酶活实验结果吻合,完成了体内体外的双重验证,从而完善了转录延伸过程中染色质乙酰化修饰的动态调控模型。
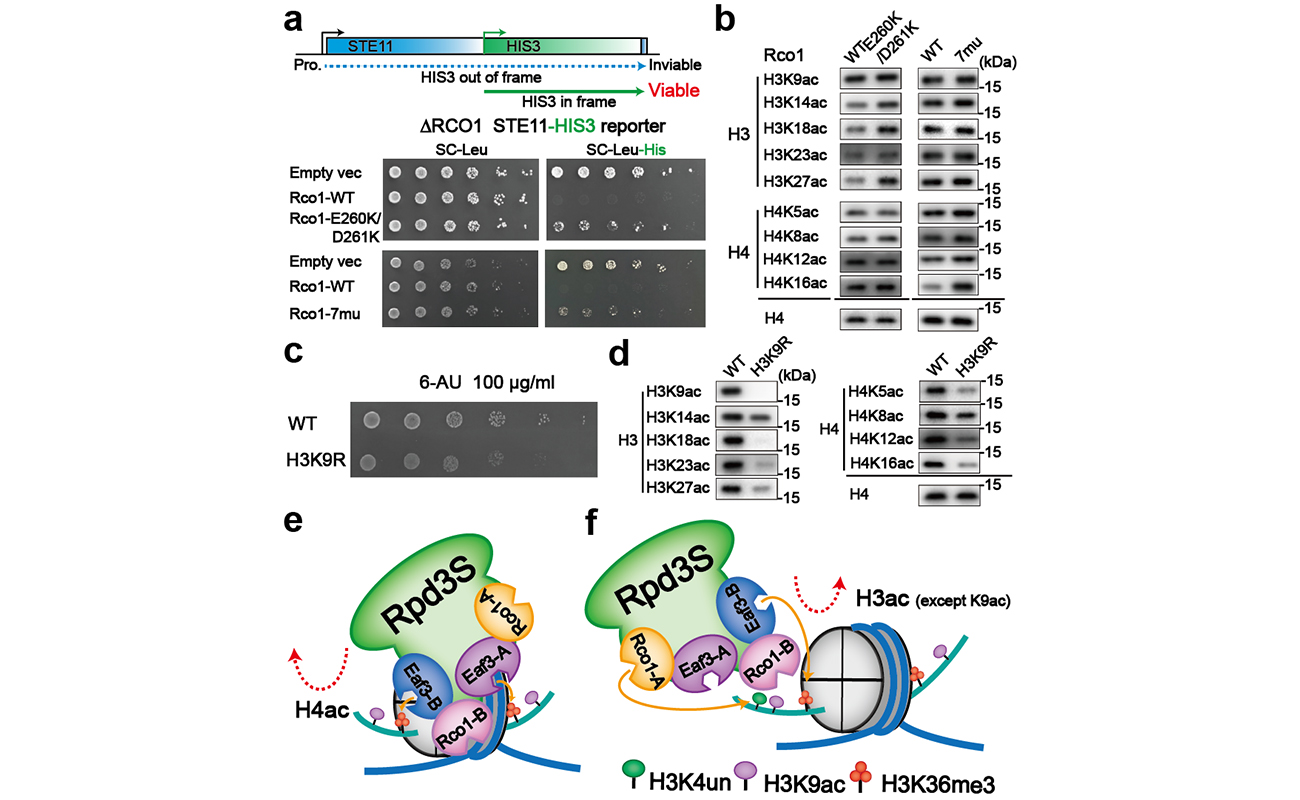
Rpd3S复合物体内功能研究和催化模型
如今,医学正从以疾病为中心的传统模式迈向以主动健康为中心的康建医学(wellness medicine)新范式,在这一变革中,精准与数智医学日益成为关键的新生力量。基因序列本身不能完全决定生物体的宿命,表观遗传学信息的建立与解读更直接地表征了个体健康与疾病的状态。因此在生命的舞台剧中,只了解基因剧本是远远不够的,更需要掌握各位演员的表演机制,从而更精准地调控各幕剧情,让生命之姿活力绽放。
(注:胡思凡对本文亦有贡献)