清华新闻网12月20日电 真核生物染色质上的组蛋白修饰能够调控染色质状态和基因表达,组蛋白修饰往往通过它们的识别蛋白发挥调控作用。以往研究表明,组蛋白乙酰化修饰和H3K4me3修饰都与基因的活跃转录密切相关,然而这两种修饰协同调控基因表达的关联机制尚待研究。
清华大学生物医学交叉研究院何新建实验室发现,拟南芥GTE4蛋白中的Bromo结构域能够特异识别组蛋白乙酰化修饰,其对组蛋白上不同赖氨酸位点的乙酰化基团的结合能力具有累加效应,并且对组蛋白H4乙酰化修饰的亲和力远高于对组蛋白H3乙酰化修饰的亲和力。对Bromo结构域中保守氨基酸进行突变能够完全阻断其对组蛋白乙酰化修饰的识别能力,揭示了其对组蛋白乙酰化修饰识别能力的特异性(图1)。
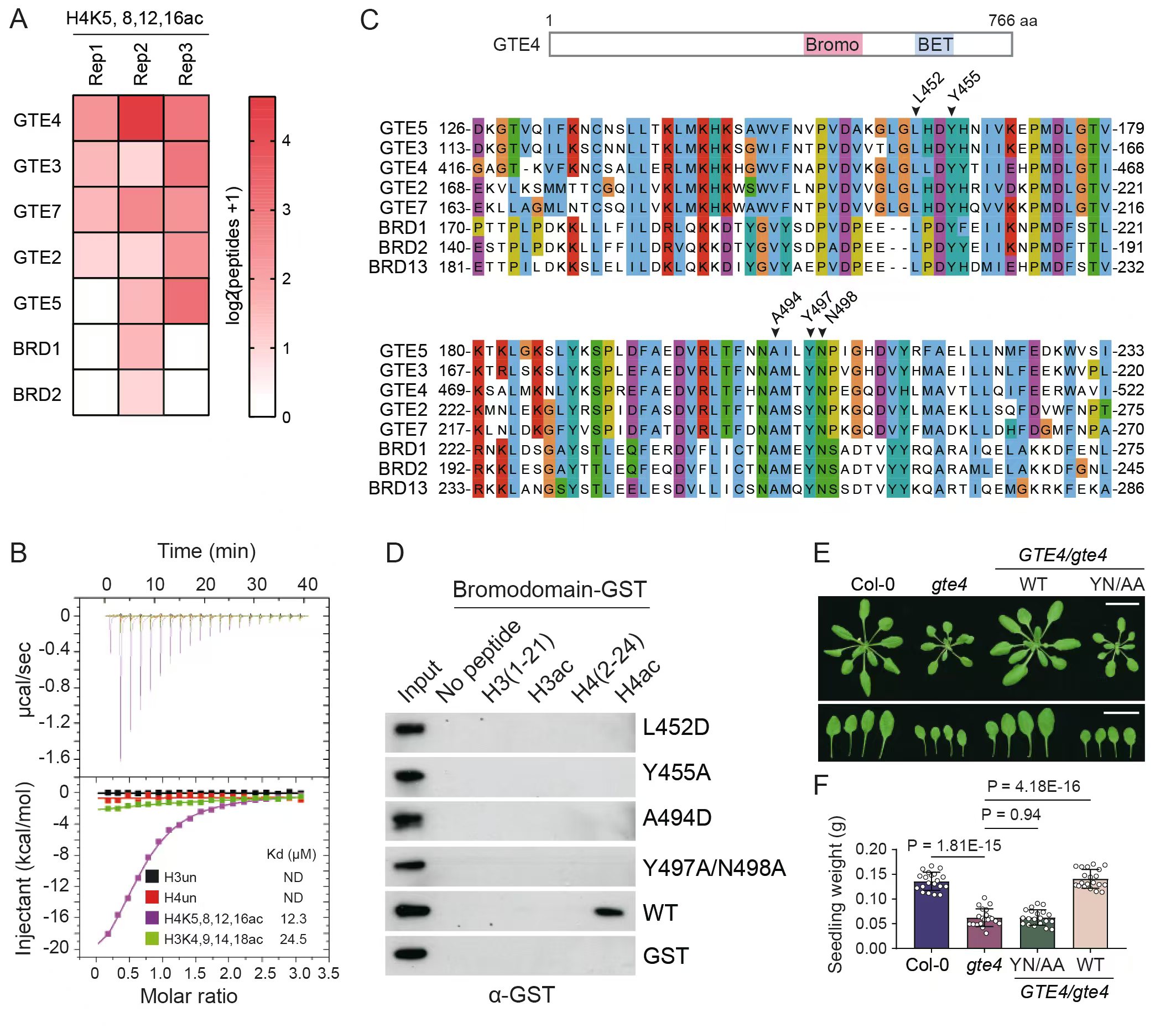
图1.GTE4通过识别组蛋白乙酰化修饰参与植物生长发育
进一步研究发现,GTE4能够与两个功能冗余的蛋白EML1和EML2(EML1/2)结合,形成GTE4-EML复合体,其中EML1/2所包含的Tudor结构域特异识别H3K4me3修饰。遗传分析发现,eml1 eml2(eml1/2)双突变体与gte4突变体具有相似的生长发育缺陷,且两种突变体中的差异表达基因高度重叠,显示GTE4和EML1/2通过形成复合体共同调控基因表达,从而参与植物的生长发育调控(图2)。
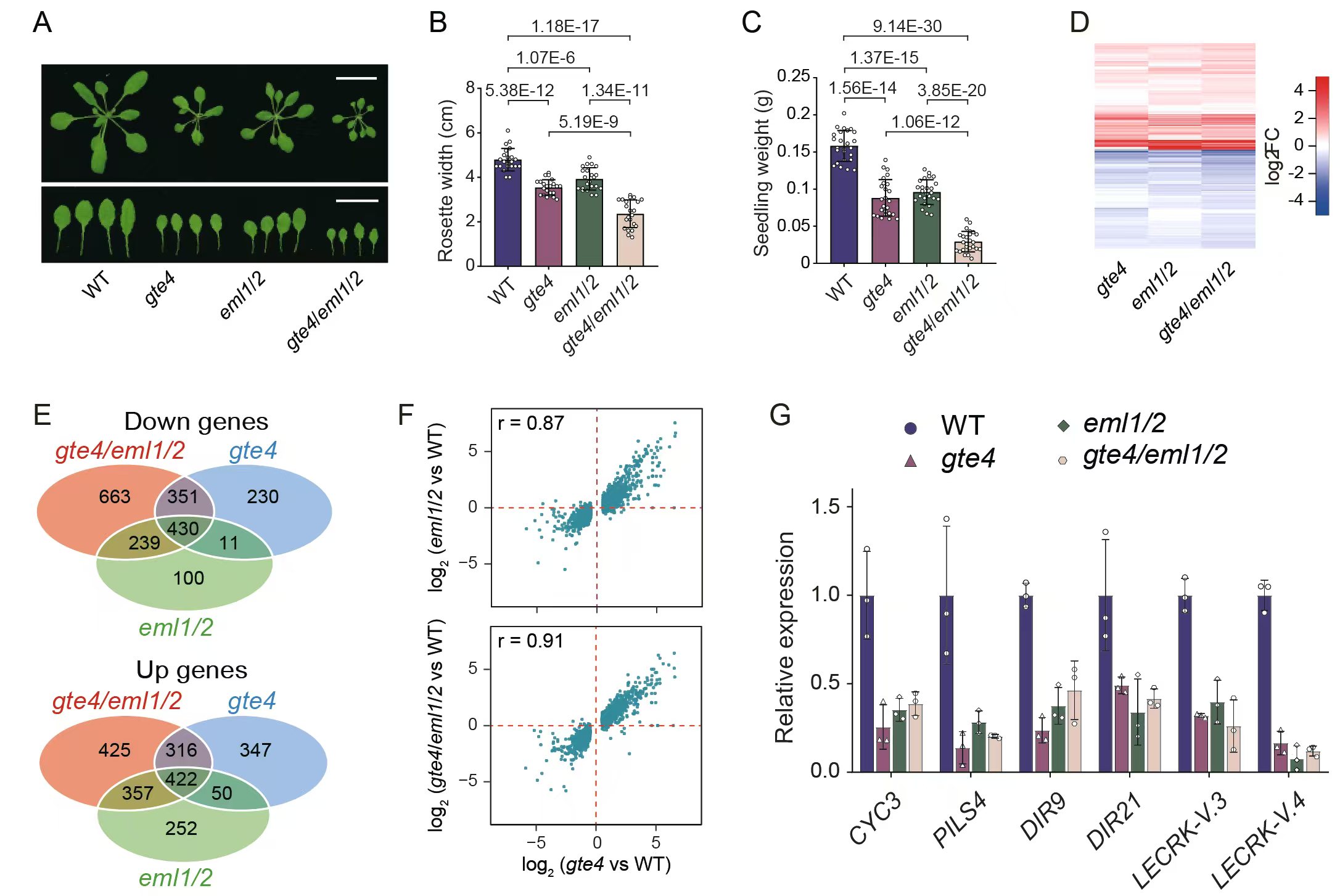
图2.GTE4和EML1/2共同调控基因表达和生长发育
通过染色质免疫沉淀结合测序分析,发现GTE4和EML2共同结合在基因组上兼具组蛋白乙酰化和H3K4me3修饰的靶基因上,二者对靶基因的结合相互促进。GTE4中Bromo结构域的突变显著降低GTE4对靶基因的结合能力,揭示了Bromo结构域对组蛋白乙酰化修饰的识别参与了GTE4对靶基因的结合。此外,发现GTE4中的一个保守的-螺旋结构域负责对EML1/2的结合,该-螺旋结构域的敲除导致GTE4对靶基因的结合能力显著降低(图3)。这些结果表明,GTE4对组蛋白乙酰化修饰的识别与EML1/2对H3K4me3修饰的识别之间相互协同,共同决定了GTE4-EML复合体对靶基因的结合能力。
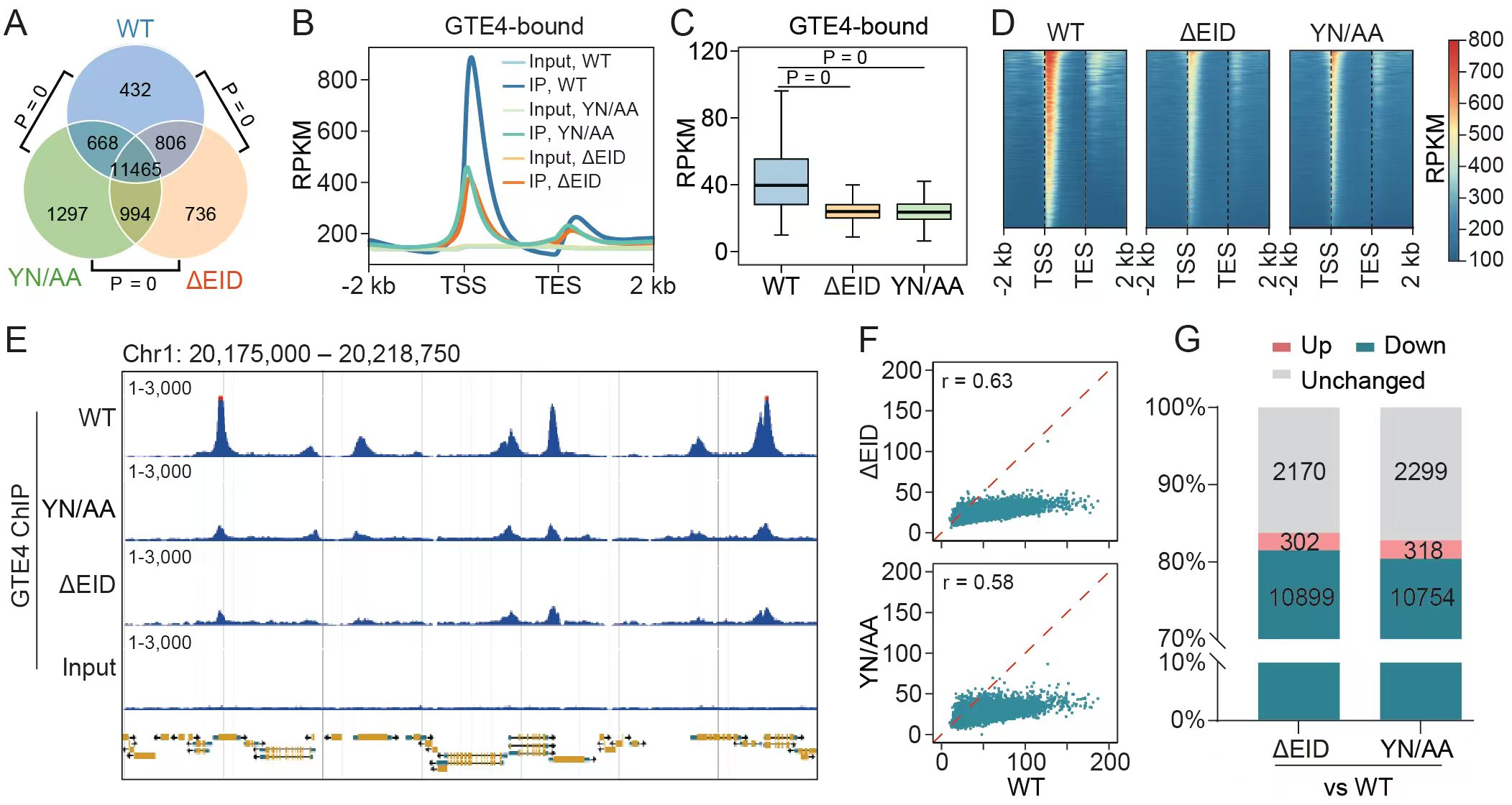
图3.GTE4中的Bromo结构域和EML结合结构域协作参与靶向
综上,该研究发现了组蛋白乙酰化修饰的识别蛋白GTE4能够与H3K4me3修饰的识别蛋白EML1/2互作形成GTE4-EML蛋白复合体,阐明了该复合体在全基因组水平结合靶基因的分子机制,拓展了对真核生物中不同组蛋白修饰互作机制的认识。
相关研究成果以“GTE4-EML染色质阅读复合物同时识别拟南芥组蛋白乙酰化和H3K4三甲基化”(The GTE4-EML chromatin reader complex concurrently recognizes histone acetylation and H3K4 trimethylationin Arabidopsis)为题,于12月18日在线发表于《植物细胞》(Plant Cell)。
何新建实验室博士后钱锋、2019届博士毕业生赵强强、2018届博士毕业生周进兴、实验室生信分析工作人员袁丹阳为论文共同第一作者,何新建研究员为通讯作者。研究得到科技部和国家自然科学基金委的资助。
论文链接:
https://doi.org/10.1093/plcell/koae330
供稿:生物医学交叉研究院
编辑:李华山
审核:郭玲
