清华新闻网12月13日电 在药物化学研究中,根据“逃离平面”概念,提高sp³杂化碳的比例和手性碳的数目可以增加候选药物分子的复杂性,从而提高其临床成功率;因此三维(3D)、饱和的、桥环类化合物在药物化学中受到广泛关注,其中BCHs能够作为多种不同取代苯基的生物电子等排体;然而,目前手性BCHs的合成方法尚未得到充分研究,且手性BCHs替代生物活性分子(或小分子药物)中的苯环及其生物活性研究还未见文献报道(图1)。
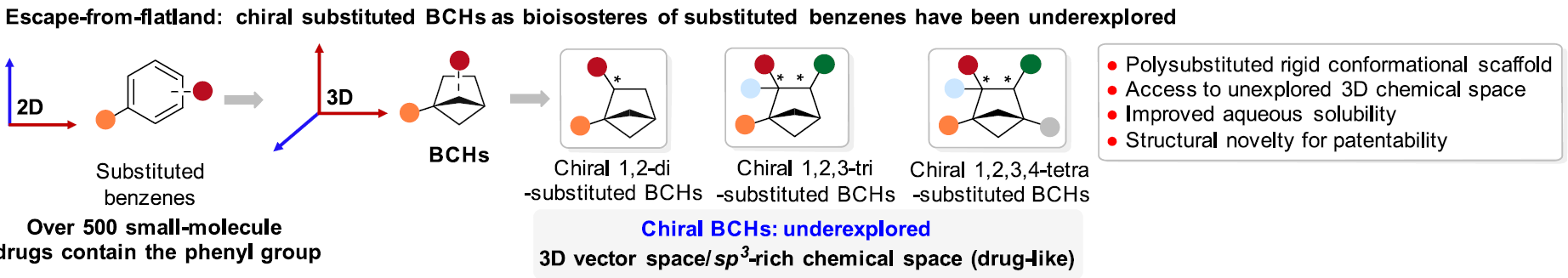
图1.文章的研究背景
针对这一挑战,清华大学深圳国际研究生院生物医药与健康工程研究院林进顺团队与南方科技大学刘心元团队携手发展了路易斯酸催化双环[1.1.0]丁烷(BCB)分别与香豆素、2-吡喃或色酮等的不对称分子间[2π + 2σ]环加成反应,以优秀的对映/非对映/区域选择性合成了结构多样的、具有邻位的三级-四级碳手性中心的、1,2,3,4-四取代的BCHs。在该反应中,手性双噁唑啉配体的引入可以有效抑制副反应、能显著地减少外消旋的背景反应,并精确调控反应活性以及区域、对映和非对映选择性,所得的手性BCHs可以替代抗肿瘤药物Sonidegib和非肽类小分子PD-1/PD-L1抑制剂BMS-202中的苯环,并合成了这两个生物活性分子的手性类似物BCHex-Sonidegib和BCHex-BMS-202(图2)。

图2.文章内容概况
研究团队接着评估了BCHex-Sonidegib和BCHex-BMS-202的理化性质和药理学特性(图3),结果显示,与阳性对照Sonidegib和BMS-202相比,BCHex-Sonidegib和BCHex-BMS-202表现出更好的溶解性和代谢稳定性;同时,它们表现出与阳性对照Sonidegib和BMS-202相当的抗肿瘤活性(MTT)(表1),在正常的肝脏细胞中表现出更低的毒性,且能诱导肿瘤细胞凋亡和抑制肿瘤细胞的克隆形成(图4)。这项研究工作是国际上首次利用手性1,2,3-三取代的BCHs替代1,2,3-三取代的苯环,突显了手性多取代BCHs作为苯环生物电子等排体在药物化学中的潜在应用。

图3.化合物的理化性质参数
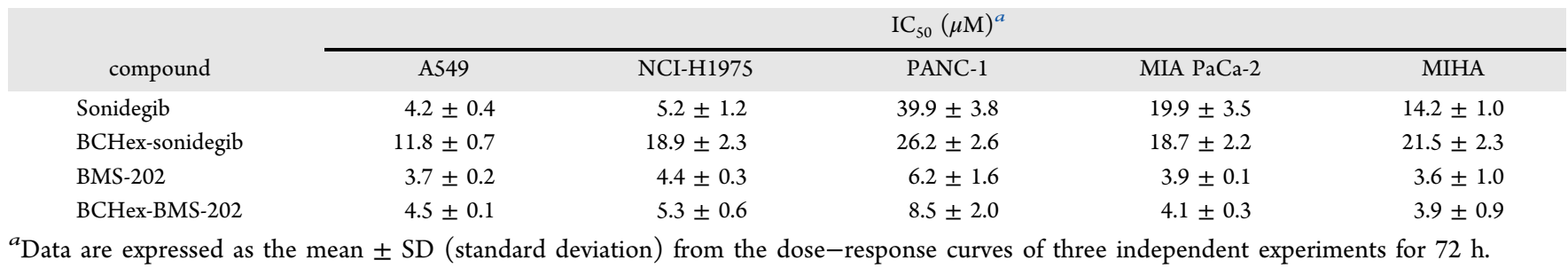
表1.化合物对人类肿瘤细胞系和正常肝细胞的抗肿瘤活性

图4.化合物抑制肿瘤细胞A549的克隆形成
相关研究成果以“路易斯酸催化双环[1.1.0]丁烷的不对称[2π+2σ]环加成反应:高效合成多取代双环[2.1.1]己烷作为手性生物电子等排体”(Catalytic Intermolecular Asymmetric [2π + 2σ] Cycloadditions of Bicyclo[1.1.0]butanes: Practical Synthesis of Enantioenriched Highly Substituted Bicyclo[2.1.1]hexanes)为题,于12月3日发表于《美国化学会志》(Journal of the American Chemical Society)。
清华大学深圳国际研究生院生物医药与健康工程研究院/省部共建肿瘤化学基因组学国家重点实验室为研究论文的第一完成单位。论文通讯作者为清华大学深圳国际研究生院林进顺讲师、南方科技大学刘心元教授,清华大学深圳国际研究生院的2021级硕士研究生李英杰、2022级硕士生吴志龙,南方科技大学顾强帅副教授和深圳湾实验室樊婷婷副研究员为共同第一作者。研究得到深圳市科技创新委员会、广东省创新计划项目和深圳湾实验室科研启动基金等的支持。
论文链接:
https://pubs.acs.org/doi/10.1021/jacs.4c10968
供稿:深圳国际研究生院
编辑:李华山
审核:郭玲
