清华新闻网12月5日电 肝脏作为人体最大的代谢器官,在药物代谢、蛋白质合成和解毒过程中具有至关重要的作用。然而,传统体外肝脏模型(如肝细胞单层培养和动物模型)在模拟人体肝脏复杂功能方面存在显著局限性,难以满足现代药物开发和代谢研究的需求。
人源肝脏模型助力药物代谢原理阐释
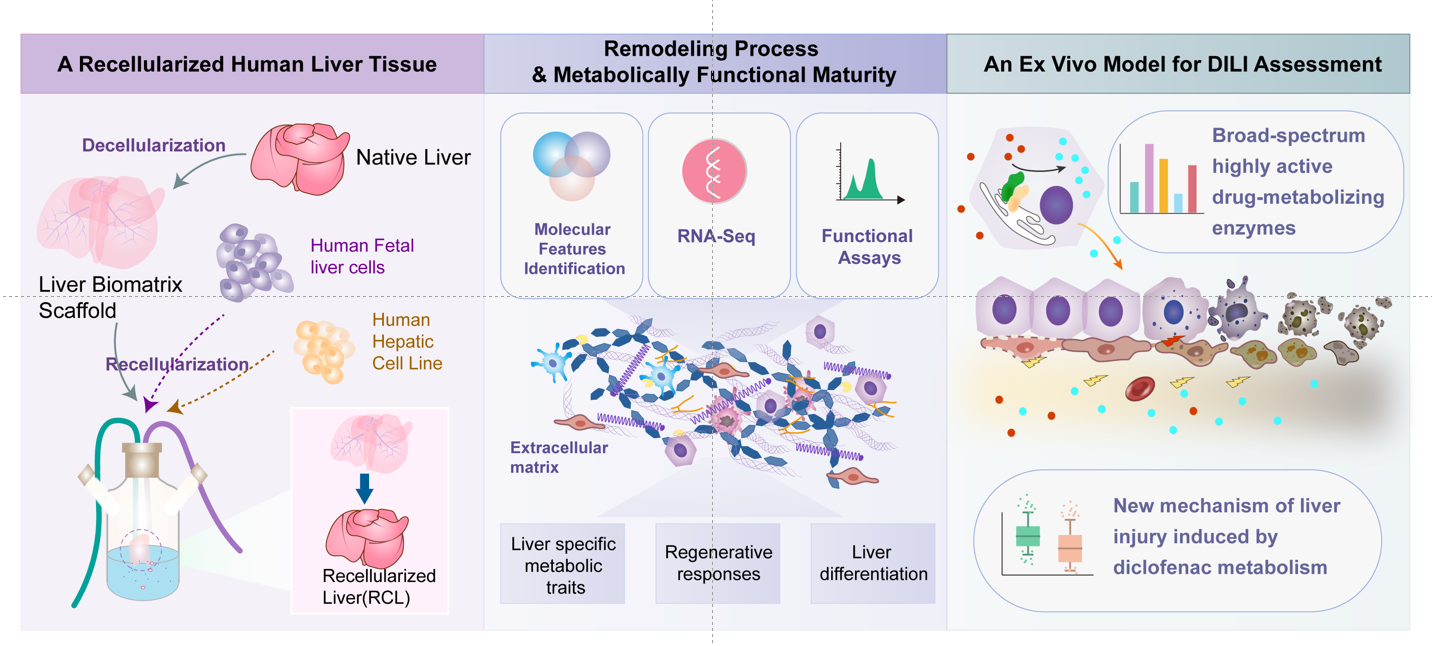
近日,针对这一挑战,北京清华长庚医院肝胆胰中心王韫芳教授团队发表最新研究成果,创新构建了功能性组织工程人源肝脏模型,开辟了体外药物代谢研究的新方向。
研究团队通过整合去细胞技术、生物材料科学和组织工程学的技术,构建出具有多层次微结构的肝脏类组织,实现了高效模拟人体肝脏微环境。这一创新的去细胞肝脏支架不仅保留了原始肝脏的细胞外基质(ECM)结构,还保留了与ECM结合的生物活性分子,为肝细胞提供了一个适宜的生长和分化环境。该模型不仅保留了肝细胞的药物代谢和解毒功能,还在蛋白质合成和酶促反应中表现出与人体内肝脏相近的活性。这一特性使得模型在评估药物安全性和有效性方面具有高度可靠性,为新药开发和个性化医疗提供了强有力的工具。
基于该模型的药物代谢实验显示,其在模拟体内肝脏毒性和药物代谢功能方面具有显著的能力,特别是在探索药物诱导的肝脏损伤(DILI)机制方面。此外,该模型还显示出高药物代谢酶活性,为研究药物诱导的肝脏损伤提供了一个有前景的途径,有助于研究人员更详细地理解早期药物发现过程。
该研究为生物医学领域提供了高仿真肝脏模型的新范例,展示了组织工程技术在药物研发、毒理学评估以及基础医学研究中的潜力。未来,团队将进一步优化模型功能,并探索其在肝病机制研究和再生医学中的应用可能性。

研究成果在《生物活性材料》上发表为封面文章
相关研究成果以“脱细胞肝脏生物支架用于构建具有药物代谢功能的离体人源肝脏模型”(Decellularized liver scaffolds for constructing drug-metabolically functional ex vivo human liver models)为题,作为封面文章发表在最新一期《生物活性材料》(Bioactive Materials)上。
王韫芳为论文通讯作者,北京清华长庚医院肝胆胰中心柳娟为论文第一作者,美国北卡罗来纳大学教堂山分校罗拉·里德(Lola Reid)教授团队对本工作给予了大力支持。研究得到国家重点研发计划、国家自然科学基金重大研究计划等的资助。
论文链接:
https://doi.org/10.1016/j.bioactmat.2024.09.029
供稿:北京清华长庚医院
编辑:李华山
审核:郭玲
