清华新闻网10月18日电 近日,清华大学药学院蒯锐课题组研究报道了一种基于透明质酸和脂质分子物理交联获得的“洋葱式”多层脂质体,阐明了纳米结构调控对小分子STING激动剂的释放和递送行为的影响,并基于此平台建立了一种能够高效激活抗肿瘤免疫应答的方法。
通过系统给药激活肿瘤组织内抗原呈递细胞(APCs)的STING通路可促进I型干扰素产生,进而提高抗肿瘤免疫应答,是一种极具潜力的肿瘤治疗策略。然而,大多数STING激动剂(如cGAMP)是带负电的亲水性小分子,在系统给药后易从体内快速清除。此外,这类分子透过生物膜的效率低,难以高效到达APCs细胞质激活STING通路。虽然科学家们开发了多种不同种类的脂质或聚合物纳米粒以提高药物向细胞质的递送效率,但这些纳米粒依然面临诸多挑战。例如在靶细胞内可实现高效细胞质递送的纳米粒在血液循环中容易过早释放药物,而在血液循环中稳定的纳米粒难以在靶细胞内实现高效的细胞质递送。如何兼顾纳米粒的稳定性和高效的细胞质递送依然是亟待解决的问题。
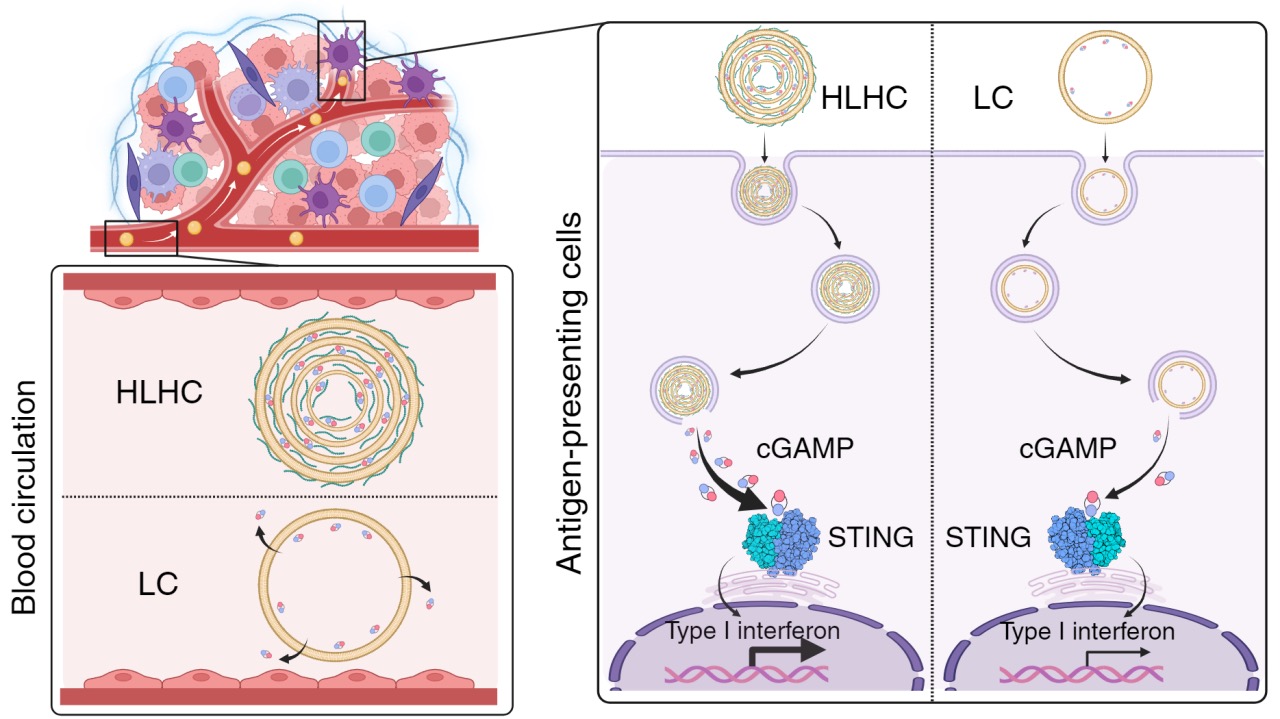
图1.普通脂质体(LC)和物理交联的多层脂质体(HLHC)的作用过程示意图
受到洋葱多层结构的启发,将具有高效细胞质递送但稳定性差的脂质制备成多层结构有望在保留细胞质递送优势的前提下兼顾稳定性。然而,目前适用于系统给药的小分子缓释多层脂质体(粒径100纳米或以下)依然非常缺乏。此外,传统的维持多层脂质结构的方法多为化学交联的形式,而化学交联剂的使用容易引发安全风险,同时也极大增加了工艺的复杂性。基于以上背景,蒯锐课题组开发了一种基于透明质酸(HA)和脂质分子物理交联制备的多层脂质体用于高效递送STING激动剂cGAMP,该制剂被命名为HLHC(HA-lipidhybrid nanoparticles encapsulating cGAMP)。使用微流控装置将HA、脂质分子、cGAMP按特定比例混合后可连续大量制备具有多层结构的脂质体HLHC。电镜下HLHC呈现出典型的“洋葱式”断面结构。体外研究表明相比于含有cGAMP的普通脂质体对照组LC(Liposomal cGAMP),HLHC具有更好的稳定性和缓释特性,能将更多的小分子递送到细胞质中激活STING通路,进而显著增强细胞分泌I型干扰素的能力。体内研究表明HLHC的多层结构可以显著延长cGAMP的循环时间,增加其在肿瘤部位的蓄积,更好激活瘤内APCs的STING通路。单次静脉注射HLHC即可在小鼠体内引发强大的抗肿瘤免疫应答并消退皮下MC38肿瘤,与检查点抑制剂联合后能消退B16F10黑色素瘤。此外,经过治疗的小鼠可建立长期的免疫记忆并免于肿瘤复发。

图2.普通脂质体(LC)和物理交联的多层脂质体(HLHC)的电镜结构(比例尺为100纳米)
该研究报道了一种利用透明质酸和脂质分子层物理交联形成多层脂质体的方法,克服了传统纳米粒在系统给药时难以兼顾稳定性和细胞质递送效率的不足。单次静脉注射HLHC即可产生强大的抗肿瘤免疫反应,消退肿瘤并建立持久的免疫记忆。此外,该制剂具有简单易于制备的特点,有望用于其他小分子的高效递送。
相关研究成果以“单剂量物理交联透明质酸和脂质杂合纳米粒递送环鸟苷酸-腺苷酸可消除已建立的肿瘤”(Single-Dose Physically Cross-Linked Hyaluronic Acid and Lipid Hybrid Nanoparticles Containing Cyclic Guanosine Monophosphate−Adenosine Monophosphate Eliminate Established Tumors)为题,于10月17日发表于《美国化学学会·纳米》(ACS Nano)。
清华大学药学院蒯锐研究员为论文的通讯作者;蒯锐课题组已毕业博士俞锦超为论文的第一作者。蒯锐课题组博士生李昕艳、孙楠,博士后李君耀作出了重要贡献。清华大学生命科学院教授李赛、博士生彭程,药学院本科生黄加一为本课题的开展提供了帮助。研究得到了国家高层次人才计划青年项目、国家自然科学基金、清华-北大生命科学联合中心、清华大学前沿交叉专项、笃实专项等的支持。
论文链接:
https://doi.org/10.1021/acsnano.4c10673
供稿:药学院
编辑:李华山
审核:郭玲
